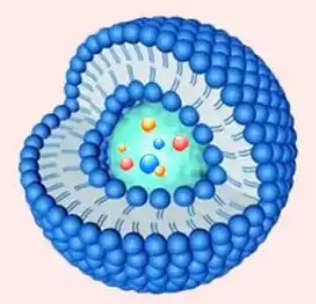
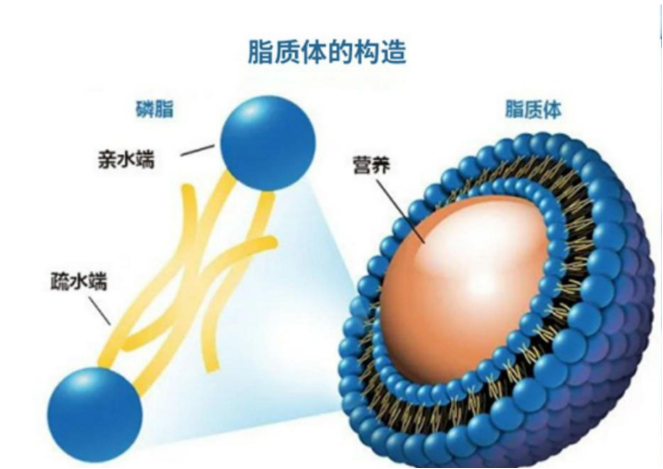
微米级脂质体是一种人工制备的脂质囊泡结构,其粒径大小在微米级别(通常为1-1000μm)。它是由一层或多层磷脂双分子层组成,内部包裹着一定的水性核心。
1.优化脂质体的组成成分
选择合适的磷脂:
不同种类的磷脂具有不同的化学稳定性和物理性质。例如,饱和脂肪酸链的磷脂(如二硬脂酰磷脂酰胆碱,DSPC)比不饱和脂肪酸链的磷脂更稳定。因为不饱和脂肪酸链中的双键容易被氧化,而饱和脂肪酸链则相对不易受到氧化攻击。在制备微米级脂质体时,可以适当增加饱和磷脂的比例来提高稳定性。
一些带有特殊官能团的磷脂也可以用于提高稳定性。例如,带有氨基或羧基的磷脂可以通过化学键合等方式与其他稳定分子相互连接,增强脂质体的结构稳定性。
添加胆固醇:
胆固醇是一种常用的脂质体添加剂,它能够插入磷脂双分子层之间。胆固醇可以调节磷脂双分子层的流动性,在一定程度上降低膜的流动性,使脂质体的结构更加紧密。当温度变化或受到外部物理因素影响时,胆固醇能够帮助维持脂质体的完整性,防止其破裂或融合。通常,胆固醇的添加量可根据具体需求在一定范围内调整,一般为磷脂摩尔量的20% - 50% 左右。
2.控制制备工艺参数
薄膜分散法:
在薄膜分散法制备脂质体过程中,控制溶剂的蒸发速度是关键。缓慢而均匀的溶剂蒸发有助于形成均匀的磷脂薄膜,从而得到结构规整的脂质体。例如,在旋转蒸发过程中,合适的旋转速度和温度可以使溶剂逐渐挥发,避免薄膜出现裂缝或不均匀现象。
水化过程也很重要。使用合适的水化介质和水化时间能够影响脂质体的粒径和稳定性。一般选择与脂质体内部成分相兼容的缓冲溶液作为水化介质,如磷酸盐缓冲液(PBS)。水化时间应足够长,以确保磷脂薄膜完全水化形成脂质体,但过长的水化时间可能导致脂质体的聚集,所以需要根据实际情况进行优化。
高压均质法或超声法(用于减小粒径):
如果需要通过高压均质法或超声法来减小脂质体的粒径,要注意控制操作参数。在高压均质过程中,压力和循环次数是重要的参数。过高的压力可能会破坏脂质体的结构,而过低的压力则可能无法达到预期的效果。通常,压力可控制在500 - 1500 bar之间,循环次数根据脂质体的初始状态和目标粒径进行调整。
超声处理时,超声功率和时间需要准确控制。高功率超声可能会使脂质体过度破碎并产生热量,导致脂质体的融合和内容物泄漏。一般超声功率可设置在100 - 500 W之间,超声时间以间歇式超声几分钟到几十分钟为宜,同时可以在冰浴中进行超声处理,以避免局部过热。
3.表面修饰策略
聚乙二醇(PEG)修饰:
PEG 是一种亲水性聚合物,将其修饰在脂质体表面可以形成一层亲水性的 “保护膜”。这层保护膜能够减少脂质体与血浆蛋白的非特异性相互作用,从而降低免疫系统对脂质体的识别和清除。
添加带电分子进行静电稳定:
在脂质体表面添加带电分子可以通过静电排斥作用来防止脂质体的聚集。例如,在脂质体表面连接带有正电荷或负电荷的磷脂或其他小分子。如果脂质体表面带有相同的电荷,它们之间会相互排斥,从而保持脂质体在溶液中的分散状态。不过,要注意控制电荷密度,过高的电荷密度可能会影响脂质体与细胞的相互作用或者引发其他不良反应。
4.储存条件的优化
温度控制:
一般来说,脂质体在较低温度下储存稳定性更好。将脂质体保存在 4℃左右的冰箱中可以降低磷脂的流动性,减缓脂质体的降解和融合过程。对于一些对温度敏感的脂质体,如含有易氧化成分的脂质体,还可以考虑在更低的温度下(如- 20℃或- 80℃)储存,但在这种情况下,需要注意冻融过程可能对脂质体结构产生的影响。
pH 值调节:
保持合适的 pH 值对于脂质体的稳定性也很重要。大多数脂质体在中性 pH 值附近(pH 6.5 - 7.5)比较稳定。因为在这个pH范围内,磷脂的带电状态和膜的稳定性相对较好。如果pH 值过高或过低,可能会导致磷脂的水解或者电荷变化,从而影响脂质体的稳定性。可以使用缓冲溶液来维持储存环境的 pH 值稳定。
避免光照和氧化环境:
光照和氧气会加速脂质体中磷脂的氧化过程,从而降低脂质体的稳定性。将脂质体储存在避光的容器中,如棕色玻璃瓶或铝箔包装的塑料容器中,可以减少光照的影响。同时,可以在储存环境中添加抗氧化剂,如维生素 E、丁基羟基茴香醚(BHA)等,或者在脂质体的制备过程中加入抗氧化剂,以防止脂质体的氧化。

 2024-12-18 作者:ws 来源:
2024-12-18 作者:ws 来源:

