引言
脂质体是由磷脂双分子层构成的纳米或微米级囊泡,其双亲性结构可同时包载亲水性和疏水性药物。脂质体的组成(如磷脂类型、胆固醇含量、功能化修饰等)直接影响其物理化学性质(如粒径、稳定性、靶向性)及药物释放行为,从而决定其应用。本文系统综述了不同组分脂质体的设计策略及其在药物递送中的适配性。
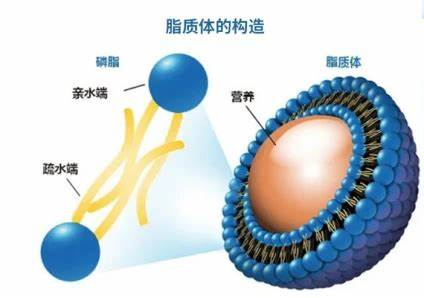
1. 脂质体组成与功能分类
1.1 传统脂质体
组分:天然磷脂(如大豆卵磷脂、蛋黄卵磷脂)与胆固醇(20-50%)。
特点:通过被动靶向(EPR效应)富集于tumor或Inflammation组织,但易被单核吞噬系统清除。
适配药物:疏水性药物(如紫杉醇)。
1.2 长循环脂质体(隐形脂质体)
组分:聚乙二醇(PEG)修饰磷脂(如DSPE-PEG2000)。
特点:PEG层减少调理素吸附,延长体内循环时间(半衰期可达48小时)。
适配药物:需长效缓释的药物、核酸类药物。
1.3 阳离子脂质体
组分:阳离子脂质(DOTAP、DC-Chol)与辅助脂质(DOPE)。
特点:通过静电作用结合带负电的核酸(如siRNA、mRNA)或蛋白,促进细胞摄取。
适配药物:基因Treatment 载体。
1.4 pH敏感脂质体
组分:pH响应性磷脂(如DOPE)与酸性可电离基团(如CHEMS)。
特点:在tumor微环境(pH 6.5)或内涵体(pH 5.0-6.0)中发生相变,触发药物释放。
适配药物:阿霉素、顺铂等药。
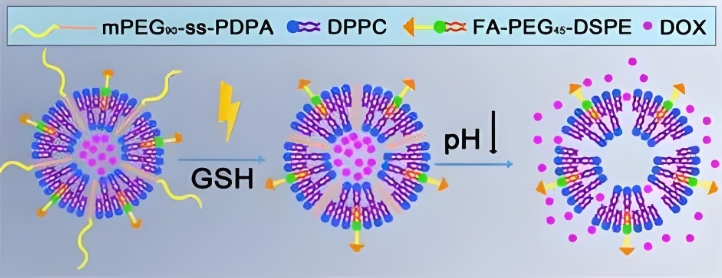
注:来自文献
1.5 温度敏感脂质体
组分:相变温度(Tm)接近生理温度的磷脂(如DPPC,Tm 41℃)。
特点:局部热疗(40-42℃)诱导脂膜通透性增加,实现时空控释。
适配药物:局部高浓度需求的药物(如5-氟尿嘧啶)。

注:来自于百度百科
1.6 配体修饰靶向脂质体
组分:表面偶联靶向分子(叶酸、转铁蛋白、抗体片段)。
特点:通过受体-配体结合实现主动靶向。
适配药物:基因编辑工具(CRISPR-Cas9)。
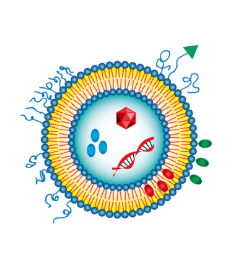
2. 药物特性与脂质体设计的适配性
2.1 药物溶解性
疏水性药物:嵌入脂质双层(如紫杉醇、姜黄素)。
亲水性药物:包封于水核(如阿霉素、顺铂)。
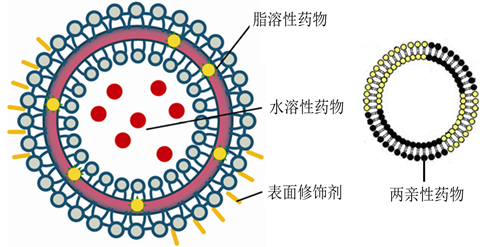
注:来自文献
2.2 药物分子量
小分子药物:传统脂质体即可高效包封。
大分子药物:需阳离子/多功能脂质体(如胰岛素、抗体)。
3
挑战与未来方向
稳定性优化:开发冻干保护剂提升脂质体长期储存稳定性。
准确递送:双靶向配体(如EGFR+CD44双抗体)增强特异性。
智能化设计:光/磁响应脂质体(如掺入金纳米颗粒)实现外部刺激控释。
临床转化:简化生产工艺(微流控技术)以降低成本。
结论
脂质体组分的高度可调性使其成为“定制化药物递送”的理想平台。未来研究需结合计算模拟(如分子动力学预测脂膜行为)与高通量筛选,加速新型脂质材料的开发。

 2025-03-24 作者:wff 来源:
2025-03-24 作者:wff 来源:

