文献:Sequentially-targeted biomimetic nano drug system for triple-negative breast cancer ablation and lung metastasis inhibition
文献链接:https://www.sciencedirect.com/science/article/abs/pii/S174270612030355X
作者:Jialong Fan , Bin Liu, Ying Long, Zhou Wang, Chunyi Tong, Wei Wang, Peidong You, Xuanming Liu
相关产品:
NH2-PEG2000-NH2 氨基 - 聚乙二醇 2000 - 氨基
DSPE-PEG2000-RGD 磷脂 - 聚乙二醇 2000 - RGD多肽
原文摘要:As a breast cancer subtype with high mortality in women, the efficient treatment of Triple-negative breast cancer (TNBC) is still a challenge due to its unique metastatic mode and poor prognosis. In this study, we developed a biomimetic nanodrug system (denoted as GTDC@M-R NPs) based on erythrocyte membrane (M)-camouflaged graphene oxide quantum dots (GOQDs, G) for TNBC therapy. The TAT (T) and RGD (R) peptides were used to endow targeting accumulation ability of Gamabufotalin (CS-6, C) and doxorubicin (DOX, D) in tumor tissue. In vitro assay indicated good biocompatibility, prolonged blood circulation time (3-fold longer than GT NPs), and effectively enhanced cell and nucleus targeting capability of this nanosystem. Fluorescence activated cell sorter (FACS) analysis indicated that the combination of DOX and CS-6 induced TNBC cell apoptosis more than 89 % under the ratio of 10:1. In vivo assay indicated that the accumulation of GTDC@M-R NPs in tumor sites increased about 2-fold compared to naked GTDC NPs, which was accompanied by high tumor apoptosis rates through blocking chemotherapy-activated cyclooxygenase-2 (COX-2) and enhancing DOX’s anti-tumor activity of chemical drugs (85 %). Moreover, comparing with the control, the average number of lung metastatic nodules in tumor-bearing mice reduced 84 %, the molecular mechanism of which is related to the down expression of COX-2, matrix metalloproteinase 9 (MMP9) and vascular endothelial growth factor (VEGF). Taken together, our results proved that the developed GTDC@M-R NPs can inhibit the growth and suppress metastasis of TNBC, which broaden our insights into the application of CS-based strategy for efficient TNBC therapy.
NH2-PEG2000-NH2中NH2 代表氨基,具有较高的反应活性。PEG2000 指的是分子量为 2000 的聚乙二醇(Polyethylene glycol)。聚乙二醇是一种线性、水溶性的聚合物,具有良好的生物相容性和稳定性。整体结构是两端为氨基,中间由聚乙二醇链段连接。DSPE-PEG2000-RGD中DSPE是 1,2 - 二硬脂酰 - sn - 甘油 - 3 - 磷酸乙醇,是一种磷脂分子,具有亲脂性的尾部和亲水性的头部。PEG2000”同样是分子量为 2000 的聚乙二醇链段。RGD 是精氨酸 - 甘氨酸 - 天冬氨酸(Arginine-Glycine-Aspartic acid)三肽序列,具有与细胞表面特定受体结合的能力。GTDC@M-RNPs是一种基于红细胞膜(M)伪装氧化石墨烯量子点(GOQDs)的仿生纳米化合物系统用于TNBCTreatment 。利用TAT (T)和RGD (R)肽赋予加马布他林(CS-6)和阿霉素(DOX)在tumor组织中的靶向积累能力。NH2-PEG2000-NH2和DSPE-PEG2000-RGD在许多方面有着应用,例如引用的这篇文献空就应用在GTDC@M-RNP的制备中。具体制备过程如下:
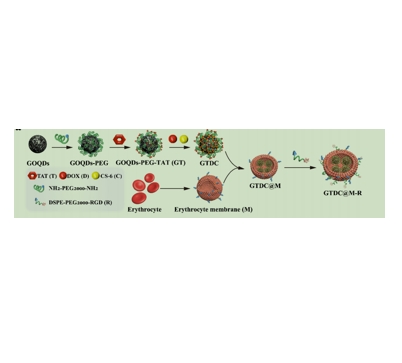
图为:RGD修饰的红细胞膜伪装GOQDs-PEG-TAT@DOX@CS-6纳米系统(GTDC@M-R NPs)的制备方案
DSPE-PEG2000-RGD在GTDC@M-R NPs合成中的应用:
GOQDs-PEG-TAT NPs分散在PBS中。加入DOX和CS-6后,在室温下搅拌混合物。通过透析去除卸载的DOX和CS-6。简单地说,从BALB/c小鼠或人身上收集的新鲜全血悬浮于含肝素的PBS溶液中离心。然后,将收集到的红细胞中加入低渗溶液,孵育。然后,将红细胞裂解液离心。用PBS重新悬浮出粉红色的沉淀物。采用超声和物理挤压的方法制备具有小尺寸的红细胞膜衍生囊泡。将GTDC NPs与红细胞囊泡混合后,得到的纳米复合物在超声和搅拌下处理。然后,将DSPE-PEG2000-RGD与GTDC@M NPs溶液孵育。然后,用PBS洗涤GTDC@M-R NPs,去除游离的DSPE-PEG2000-RGD。最后,离心收集制备的GTDC@M-R NPs,保存进一步使用。在室温下,用极化纳米分析仪测量了GOQDs、GOQDs-PEG、GT、GTDC、GTDC@M和GTDC@M-R NPs在PBS中的zeta电势和动态光散射(DLS)。
NH2-PEG2000-NH2在GTDC@M-R NPs表征上的应用:
GOQDs由于其良好的生物相容性、超小尺寸和可调改性,是构建输送系统的最佳矩阵。典型TME图像显示GOQDs,高分辨率透射电镜(HRTEM)表示规则的晶格GOQDsd。通过NH2-PEG2000-NH2的连接体对其表面的TAT肽(靶向分子)进行修饰后,GOQDs-PEG-TAT(GT NPs)的平均直径和厚度分别增加。FT-红外光谱也支持了TAT肽在GOQDs表面的成功表面功能化。与GOQDs相比,在GOQDs-PEG光谱中出现了NH2-PEG2000-NH2。与此同时,由于-羧基的碳基拉伸和N-H的不对称拉伸,峰强度增加。据报道,DOX和CS-6可以通过π-π堆叠和范德华相互作用加载到GT NPs(GTDC NPs)表面。接下来,使用超声和物理挤压制备原始红细胞膜衍生的纳米红细胞体。采用物理挤压法,将纳米红细胞体涂覆在GTDC NPs上,得到GTDC@M-R NPs。SDS-PAGE蛋白分析显示,CD47和CD59的膜标记物在整个颗粒合成过程中大部分被保留。然后,紫外-可见光谱清晰地显示了红细胞膜、DOX和CS-6分别的特征峰。同时,用红细胞膜涂层后,GTDC NPs出现了特征峰。透射电镜图像显示,GTDC@M-R NPs具有典型的核壳结构,并观察到几个球形核被单层膜包围。

图为:GTDC@M-R NPs的TEM图像
结论:PEG(聚乙二醇)具有良好的水溶性和生物相容性,能够在纳米化合物表面形成一层保护膜,防止纳米颗粒聚集和沉淀。NH2-PEG2000-NH2 中的 PEG2000 链段可以增加 GTDC@M-R NPs 的稳定性,使其在体内循环过程中保持良好的分散状态,延长化合物的作用时间。RGD(精氨酸 - 甘氨酸 - 天冬氨酸)是一种常见的靶向配体,能够与tumor细胞表面高表达的整合素受体特异性结合。DSPE-PEG2000-RGD 中的 RGD 序列可以使 GTDC@M-R NPs 具有靶向tumor细胞的能力,提高化合物在tumor部位的富集程度,增强效果。通过与整合素受体结合,纳米化合物可以被tumor细胞内吞,实现化合物的靶向递送,减少对正常组织的副作用。

 2025-02-14 作者:lkr 来源:
2025-02-14 作者:lkr 来源:

